蛋白质表面在蛋白质与其他生物分子间的相互作用中扮演着关键角色,然而,蛋白质表面的结构动态变化尚未得到充分的研究。蛋白质与DNA的结合机制是生物学研究中的一个重要领域。蛋白质表面的阳离子基团与相邻的阴离子侧链形成氢键和/或脱水盐桥,这些相互作用的多样性可能决定了蛋白质与DNA之间不同的结合模式。
金沙集团1862cc/北京凝聚态物理国家研究中心陆颖研究团队与南京大学李文飞研究团队合作,用20个碱基的寡核苷酸作为探针,通过单分子力谱、二维红外光谱、结合分子动力学模拟,研究了生理浓度下钠离子诱导的DNA单链结合蛋白(SSB)表面的氢键和/或盐桥网络的协同重组,并引发蛋白质表面二态结构转变。
团队运用磁镊技术研究了20nt的寡核苷酸与SSB的结合/解离的动态过程,发现在依赖于浓度的临界力(Fc)下,结合与解离达到动态平衡,可推算出非受力状态下的结合能。随着盐浓度的连续变化,Fc和结合能皆发生非连续变化,并在特定盐浓度下两个Fc值和两个结合能共存。运用二维红外光谱分析和分子动力学模拟揭示了SSB表面在不同NaCl浓度下的结构。随着Na+浓度的增加,SSB本身的主链结构维持不变,而蛋白质表面的氨基酸侧链的排布随着盐浓度而改变。分子动力学模拟揭示SSB表面螯合了Na+后,表面的氢键网络发生重排,从“Na+-unbridged” 态向 “Na+-bridged”态转变,SSB表面静电势景观的拓扑结构发生转变,从而使得单链DNA在SSB表面的缠绕轨迹发生改变。研究结果表明钠离子通过与蛋白质表面的带电氨基酸螯合,改变了蛋白质表面的氢键网络,从而改变蛋白质表面的静电势景观和蛋白质-DNA相互作用模式。这种蛋白质表面的结构动态变化对于理解SSB如何与单链DNA相互作用至关重要,对认识蛋白质-配体相互作用的调控机制也具有重要意义,或可为未来相关药物设计和生物技术应用提供新的思路。
此工作受到了国家自然科学基金、金沙集团1862cc战略重点研究项目、金沙集团1862cc青年创新促进会、国家重点研发计划以及国科温州研究院的经费支持。物理所徐春华副研究员、博士生陆越、苑帅康和南京大学博士生吴逸超为共同第一作者,金沙集团1862cc陆颖研究员、李明研究员、李运良副研究员和南京大学李文飞教授为本文的共同通讯作者。相关成果以“Sodium Ion-Induced Structural Transition on the Surface of a DNA-Interacting Protein”为题,发表于Advanced Science(http://doi.org/10.1002/advs.202401838)。
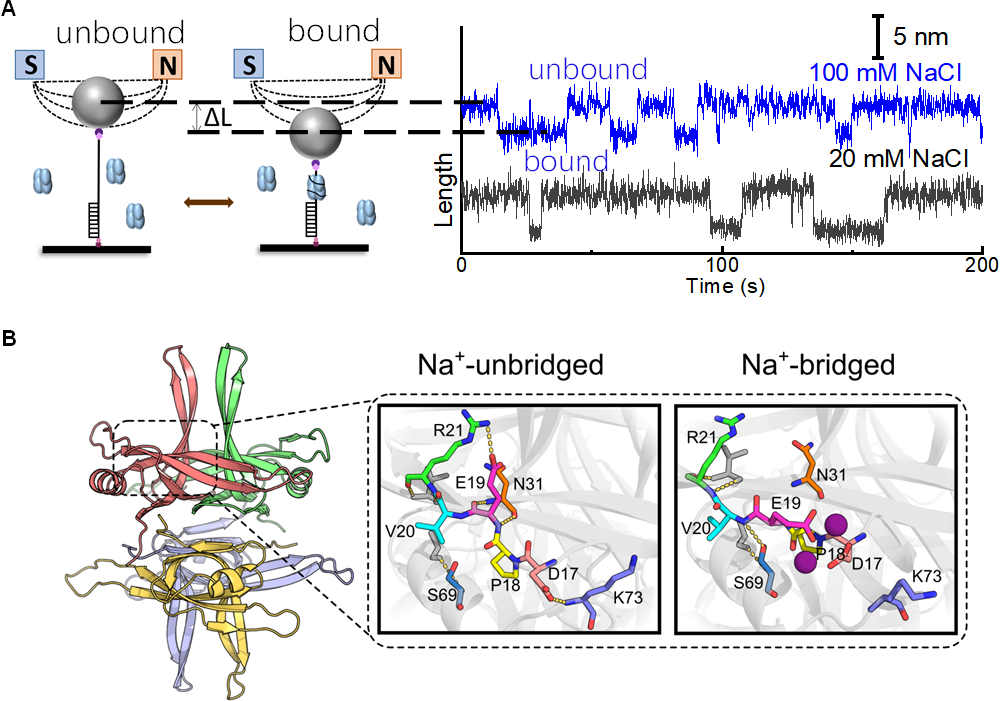
图 DNA单链结合蛋白(SSB)表面的氢键和/或盐桥网络的协同重组。(A)单分子磁镊测量SSB与ssDNA的结合/解离现象;(B)分子动力学模拟

